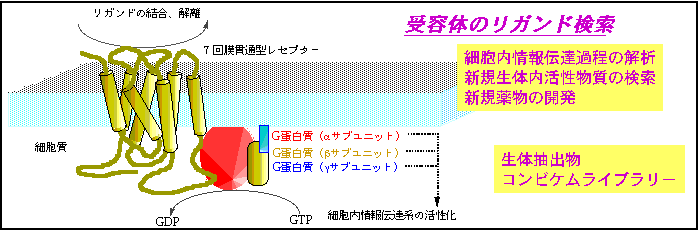
Gタンパク質共役受容体キナーゼ(Gタンパクしつきょうやくじゅようたいキナーゼ、英: G protein-coupled receptor kinase、略称: GRK)は、AGCグループ(プロテインキナーゼA、プロテインキナーゼG、プロテインキナーゼC)に属するプロテインキナーゼのファミリーの1つである。他のAGCキナーゼと同様、GRKはATPを利用して標的タンパク質の特定のセリン・スレオニン残基にリン酸基を付加する。GRKはGタンパク質共役受容体(GPCR)の細胞内ドメインに対してリン酸化を行う。GRKはアレスチンとともに機能し、GPCRによるヘテロ三量体Gタンパク質やGタンパク質非依存的シグナル伝達経路の刺激を調節する。
種類
活性と調節
通常、GRKは不活性化状態で存在するが、キナーゼ活性はリガンドによって活性化されたGPCRへの結合によって刺激される。このことは、他のAGCキナーゼでは調節部位のリン酸化による活性化が一般的機構となっているのとは対照的である。ヒトではGPCRは800種類以上存在するのに対し、GRKは7種類(体内で広く発現しているのはそのうち4つのみ)しか存在せず、そのためGRKによるリン酸化部位選択性は限定的であり、主にGPCRの活性化状態によって調節されているようである。
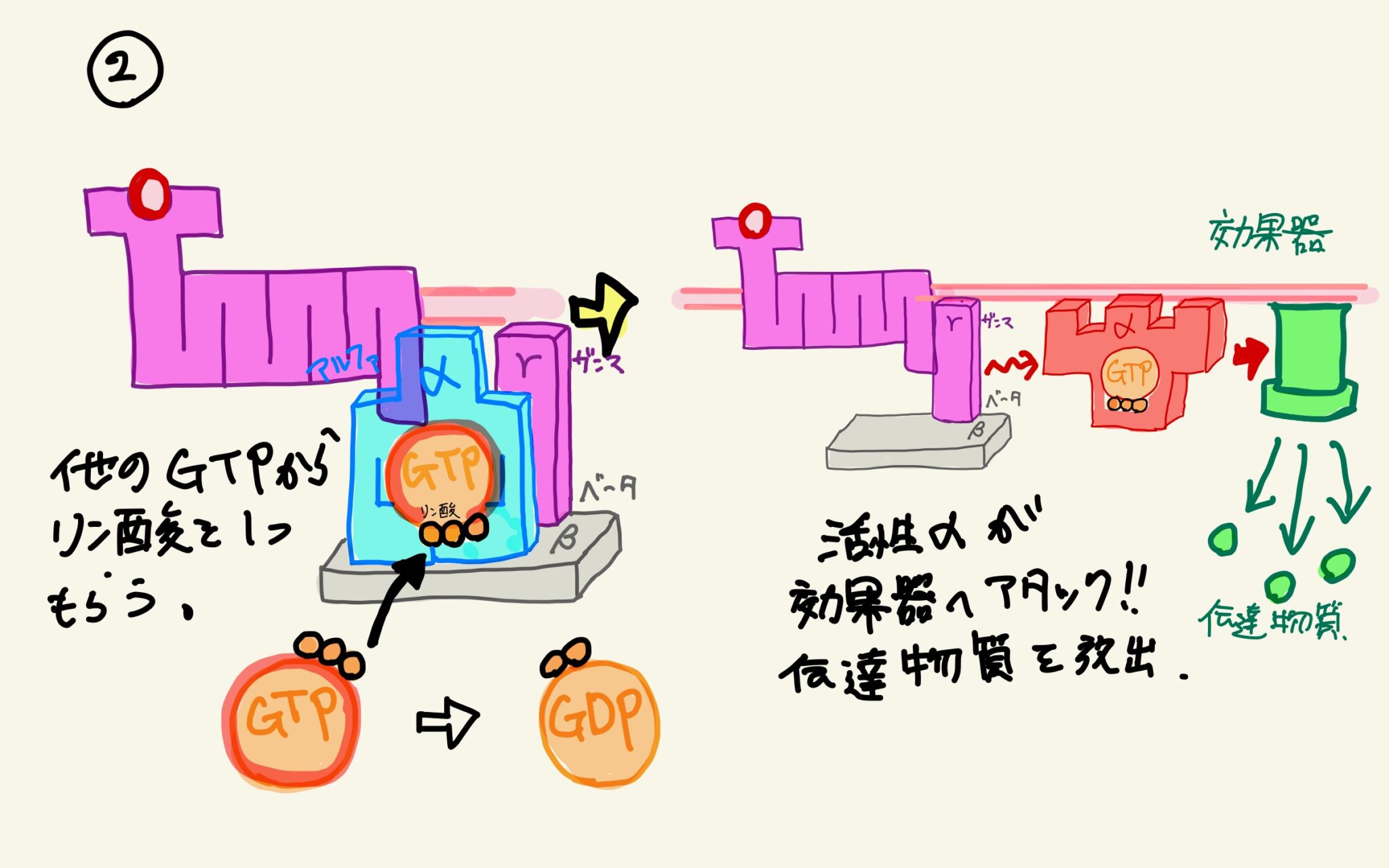
GRKは活性化されたGPCRをリン酸化し、受容体に対するアレスチンの結合を促進する。GPCRのリン酸化セリン/スレオニン残基は、アレスチンの結合部位、そして活性化部位として作用する。リン酸化された活性型受容体に対してアレスチンが結合することで受容体によるヘテロ三量体Gタンパク質の刺激が阻害され、その細胞シグナル伝達経路が遮断されるとともに、受容体の脱感作が引き起こされる。また、アレスチンの結合は受容体をインターナリゼーション経路へ導き、受容体を細胞表面から除去することでさらなる活性化を防ぐ。リン酸化された活性型受容体へのアレスチンの結合は、アレスチンの結合パートナーを介したシグナル伝達も引き起こす。このように、GRK/アレスチンシステムはGPCRに対して複雑なシグナル伝達スイッチとして機能する。
GRKは細胞内のシグナル伝達イベントによって調節されており、受容体シグナルによってGRKの活性が変化する直接的なフィードバック機構に加えて、特定のGPCR/GRKシステムとは異なる経路から発せられたシグナルによる調節も存在している。一例として、GRK1はカルシウムセンサータンパク質リカバリンによって調節されている。カルシウムが結合したリカバリンはGRK1に直接結合し、ロドプシンをリン酸化して脱感作する能力を阻害する。ロドプシンは網膜に位置する視覚関連GPCRであり、光によって活性化された桿体細胞では細胞内のカルシウム濃度が上昇してこうした阻害が生じるのに対し、暗順応した目では桿体細胞のカルシウム濃度は低く、GRK1はリカバリンによる阻害を受けない。また非視覚型GRKは、カルシウム結合タンパク質カルモジュリンによる阻害を受ける。GRK2とGRK3には共通してC末端にPHドメインが存在し、ヘテロ三量体Gタンパク質のβ/γサブユニットに結合する。GPCRによるヘテロ三量体Gタンパク質の活性化に伴って解離したβγ複合体はGRK2/3を結合し、GRKを細胞膜上の活性型受容体の位置へリクルートすることで活性型受容体調節活性を高める。他にも、GRK2の活性はプロテインキナーゼAやプロテインキナーゼCによるリン酸化、システイン残基のS-ニトロシル化によって調節されている。
構造
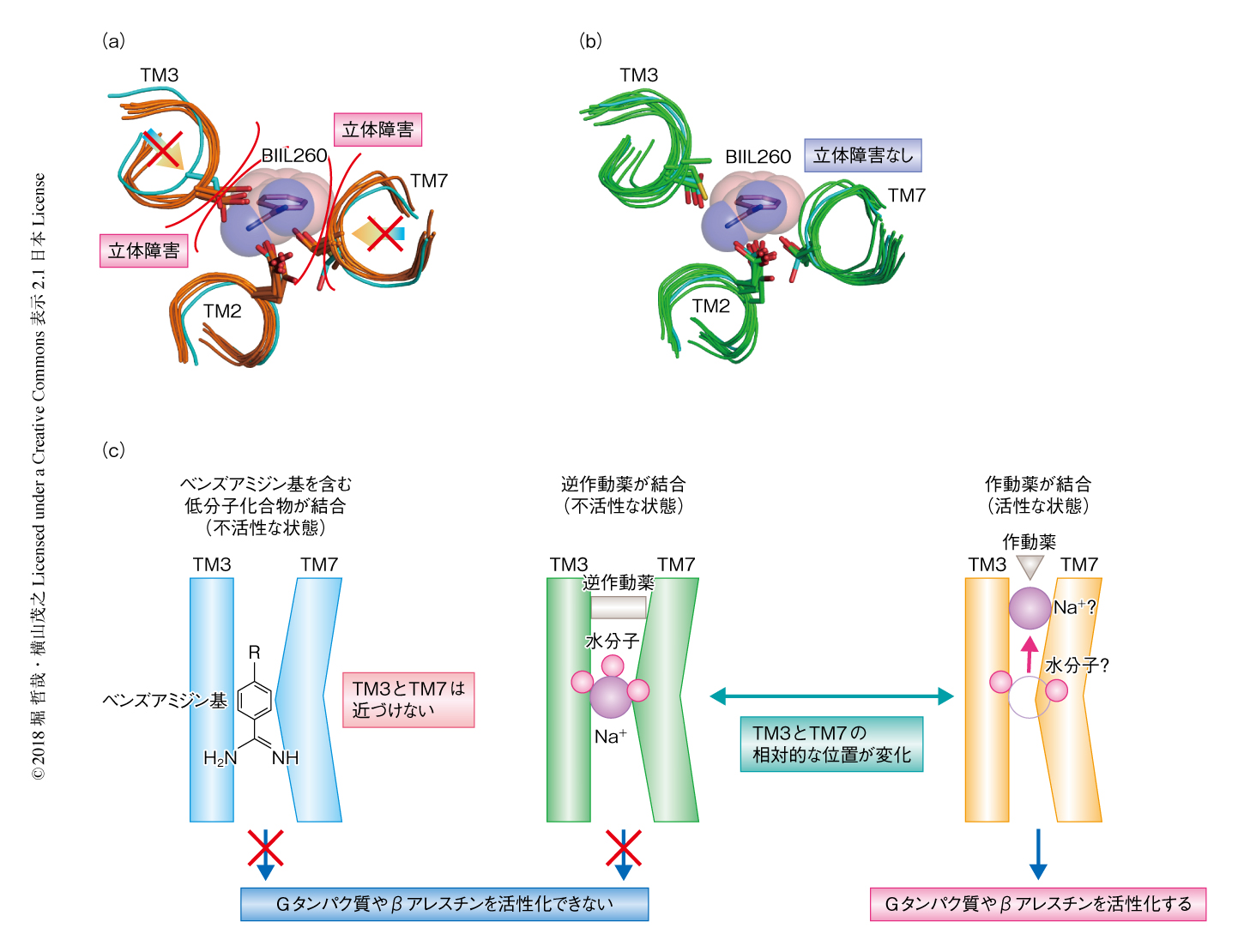
いくつかのGRK(GRK1、GRK2、GRK4、GRK5、GRK6)については、単体構造やリガンド結合構造がX線結晶構造解析によって得られている。GRKは全体的に配列相同性を示し、中心部のプロテインキナーゼドメインに加えて、RGSタンパク質と相同性を示すRH(RGS-homology)ドメイン、そしてさまざまなC末端テール調節領域というドメイン構成をしている。フォールディングした状態では、キナーゼドメインは典型的な2つのローブからなる構造をとり、その中心部にATPを結合する活性部位が存在する。RHドメインはタンパク質N末端のαヘリカル領域と、キナーゼドメイン直後の短い配列からなる2本のαヘリックスから構成され、キナーゼドメインの片側と広範囲で接触している。構造モデリングや変異体解析からは、RHドメインがGPCRの活性化を検知し、キナーゼの活性部位を開く役割を果たしていることが示唆されている。
生理的機能
GRK1は視覚系において、アレスチン1(S抗原とも呼ばれる)とともにロドプシンのリン酸化と不活性化に関与している。GRK1の欠陥は小口病の原因となる。同様に、GRK7は錐体アレスチン(アレスチン4、X-アレスチン)とともに錐体のオプシンのリン酸化と不活性化を調節している。
GRK2はβ2アドレナリン受容体をリン酸化する酵素として同定され、当初はβアドレナリン受容体キナーゼ(βARK、βARK1)と呼ばれていた。GRK2は心不全時に過剰発現するため、将来的にGRK2の阻害は心不全の治療法となる可能性がある。
GRK4遺伝子の多型は、遺伝性・後天性の双方の高血圧と関連付けられており、その一部は腎臓のドーパミン受容体を介した作用によるものである。GRK4は成熟中の精細胞においてmRNAレベルで最も高度に発現しているGRKであるが、GRK4を欠くマウスでも妊孕性は維持されているため、これらの細胞における役割は不明である。
アフリカ系で最も一般的にみられるGRK5の41番残基の多型(グルタミンからロイシンへの変化)は、喘息治療薬の標的となっている気道のβ2アドレナリン受容体の脱感作を増大させる。ゼブラフィッシュやヒトでは、GRK5の機能喪失は内臓錯位による心臓の欠陥と関係している。内臓錯位は、器官形成時の左右非対称性の異常を原因とする一連の発生欠陥である。
マウスでは、線条体におけるGRK6によるドーパミンD2受容体の調節によって、ドーパミンを介して作用する精神刺激薬への感受性に変化が生じることが示されており、パーキンソン病や、L-ドーパによる抗パーキンソン治療の副作用であるジスキネジアと関係していることが示唆されている。
GPCR以外に対する機能
GRKはGPCR以外の基質もリン酸化する。GRK2やGRK5は、PDGF受容体やIGF-1受容体など、一部の受容体型チロシンキナーゼをリン酸化する。
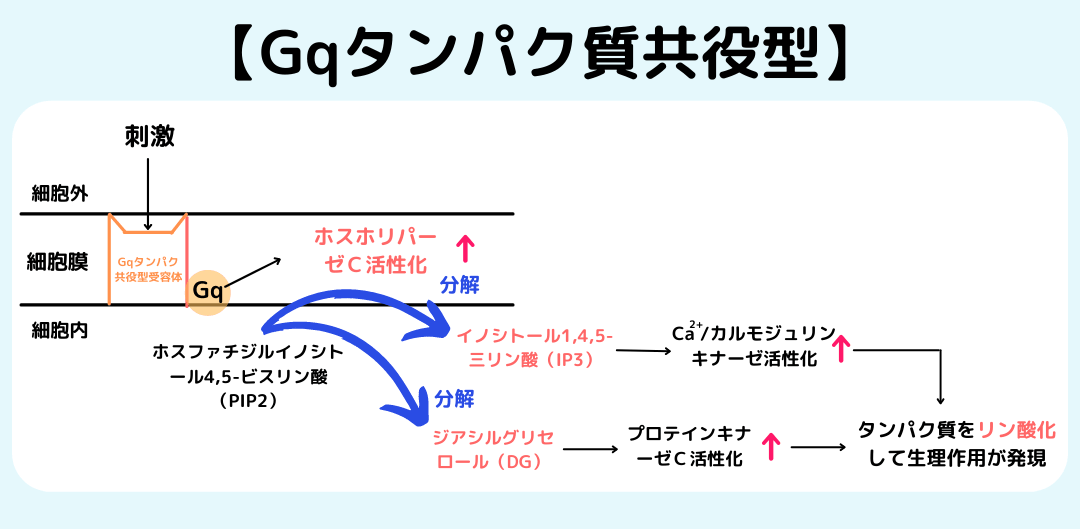
また、GRKはキナーゼ活性非依存的な細胞応答調節も行う。特に、GRK2にはGPCR以外にも多様なレパートリーのタンパク質と相互作用することが知られている。GRK2やGRK3のRHドメインはGq型のヘテロ三量体型Gタンパク質のサブユニットと相互作用するが、他の典型的なRGSタンパク質のようにGTPアーゼ活性化タンパク質として作用することはできず、そのためこうした結合は活性型Gタンパク質をPLCβなどのエフェクタータンパク質から隔離し、Gqシグナルを減弱させる。
出典
関連文献
関連項目
- Gタンパク質共役受容体